Знания о кинетических константах химических и энергообменных процессов необходимы во многих приложениях: атмосферная химия, лазерная физика, физика плазмы и физика и химия горения. В наших исследованиях мы используем следующие методы: импульсный лазерный фотолиз (ИЛФ), лазерно-индуцированная флуоресценция (ЛИФ), эмиссионная спектроскопия (ЭС) и абсорбционная спектроскопия (АС). В фокусе наших исследований находятся элементарные химические и энергообменные процессы с участием электронно- и колебательно-возбужденных частиц в кислородно-йодной среде.
Система I/O2/I2 интересна тем, что обе молекулы и атом имеют низколежащие электронные уровни с энергиями порядка 1 эВ, поэтому имеет место сложная динамика процессов с вовлечение электронных и колебательных состояний. Эта система также интересна тем, что она имеет практическое использование в кислородно-йодном лазере (КИЛ). Уровни энергий I, O2, I2 и H2O, вовлеченных в кинетику активной среды КИЛ, показаны на рис. 1.
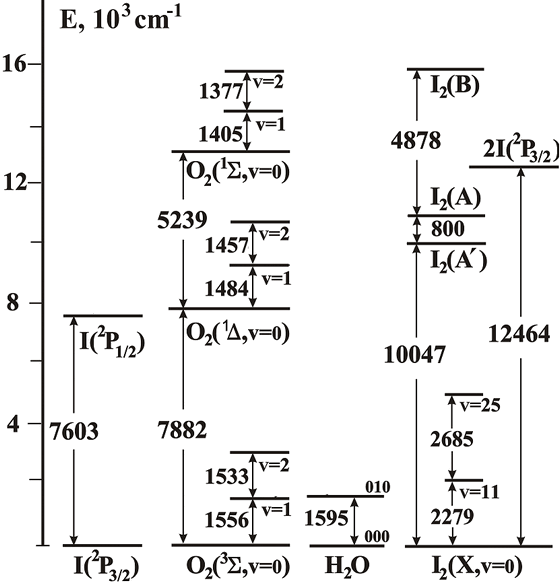
Рис. 1. Энергии низколежащих уровней O2, I2, H2O и I.
Молекулы O2(a1Δ) нарабатывались в струйном генераторе синглетного кислорода (ГСК). Давление газа в реакционной зоне ГСК составляло 35 Toрр. Кислородный поток затем поступал в измерительную ячейку. Пары йода с несущим его буферным газом (N2) инжектировались в измерительную ячейку в сопловом смесительном блоке. Давление газа в измерительной ячейке было около Pc ≈ 3 Toрр. Рис. 3 представляет эмиссионные спектры кислорода в диапазоне длин волн 757 -785 нм для двух начальных долей паров йода в кислородном потоке. Точка наблюдения находилась на расстоянии L = 5 cм от соплового блока.
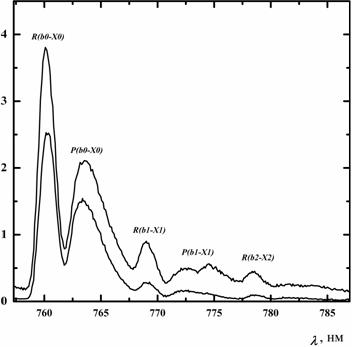
Проведенный анализ спектров испускания показал, что доли колебательно возбужденных молекул O2(b1Σ) на первом и втором колебательных уровней в максимуме достигали, соответственно, 22% и 10%. Быстрый ЕЕ-обмен между тремя состояниями кислорода X3Σ, a1Δ и b1Σ устанавливает практически равномерное распределение колебательных квантов по всем трем электронным состояниям. (Antonov I.O. et al. J. Chem. Phys., vol. 119, 2003, p. 10638-10646, doi: 10.1063/1.1621620).
Каналы диссоциации I2 в присутствии молекул O2(a1Δ). Механизм диссоциации I2 в присутствии синглетного кислорода O2(a1Δ) остается важной не до конца разрешенной проблемой в КИЛ. Хорошо установлено, что процесс диссоциации йода имеет инициирующую и цепную стадии и, что возбужденные промежуточные состояния вовлечены в процесс. [Azyazov V.N., Quantum Electronics, vol. 39, 2009, p. 989-1007, doi: 10.1070/QE2009v039n11ABEH014014]. Важно было идентифицировать промежуточные состояния и определить механизмы их возбуждения, как на инициирующей, так и на цепной стадиях.
Проблема диссоциации йода стала объектом исследований для гранта U.S. Civilian Research & Development Foundation (CRDF) “Determination of dominant I2 dissociation pathway in singlet oxygen” (№ RC1-2516-SA-03), которая выполнялась совместными усилиями двух исследовательских групп из США (Университет Эмори, руководитель Michael Heaven) и из России (Самарский филиал Физического института им П.Н. Лебедева РАН, руководитель Валерий Азязов). В рамках выполнения гранта были получены новые кинетические данные с использованием диодной лазерной спектроскопии и ИЛФ в американской группе и с использованием проточной камеры и эмиссионной спектроскопии в российской группе.
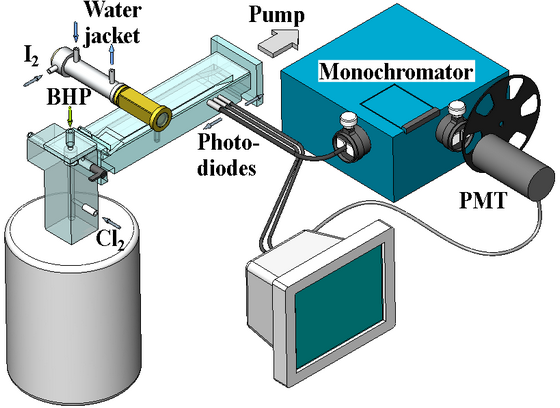
Многопараметрическое экспериментальное исследование было проведено на экспериментальной установке схема которой показана на рис. 2. Действие установки демонстрируется двумя короткими фильмами 1 и 2. Для наработки O2(a1Δ) использовался струйный ГСК, реакционная зона которой представляла собой цилиндрический канал диаметром 12 мм и высотой 10 cм. Газообразный Cl2 вводился в реакционную зону в нижней части ГСК, а раствор перекиси водорода (BHP) в виде струй инжектировался сверху (противоточный режим работы). Инжектор струй состоял из 85 трубочек из нержавеющей стали. Доля O2(a1Δ) в кислородном потоке составляла около 65 %, а степень утилизации хлора превышала 95 %.
Измерительная ячейка, изготовленная из оргстекла, имела
газовый тракт прямоугольного сечения 1.5x5 cм2. Пары йода вместе с несущим
его буферным газом вводились в кислородный поток в смесительном сопле.
Излучение из реакционной зоны выводилось через прозрачные боковые стенки
измерительной ячейки и перехватывалось Si и Ge фотодетекторами и
оптоволоконным жгутом. Полосы излучения отделялись с помощью широкополосных
оптических фильтров и монохроматора. Фотодетекторы с
фильтрами и конец оптоволоконного жгута устанавливались на подвижной
платформе.


Рис. 4. Фильмы демонстрирующие работу установки - проточная камера низкого давления. Вертикальная светящаяся полоса в реакционной зоне ГСК образована излучением димолей синглетного кислорода на длине волны 634 нм при давлении кислорода 30 Toрр. Горизонтальная красная полоса в фильме 1 обусловлена свечением димоля синглетного кислорода при давлении кислорода 10 Toрр, а в фильме 2 светящаяся полоса образована излучением молекулы I2 в видимой области спектра. Кликните на изображение чтобы загрузить и проиграть фильм.
Мы провели регистрацию излучений для следующих переходов: I2(B) --> I2(X), O2(b1Σ) --> O2(X3Σ), I(2P1/2) --> I(2P3/2) в широкой области изменений составов смеси. Как пример, рис. 5 показывает распределения концентраций возбужденного атомарного йода I* вдоль координаты по потоку L для смеси O2:N2 = 1:1, при относительном содержании паров воды 3% и относительной доле молекул O2(a1Δ) в кислородном потоке ≈60% для нескольких относительных начальных концентраций I2.
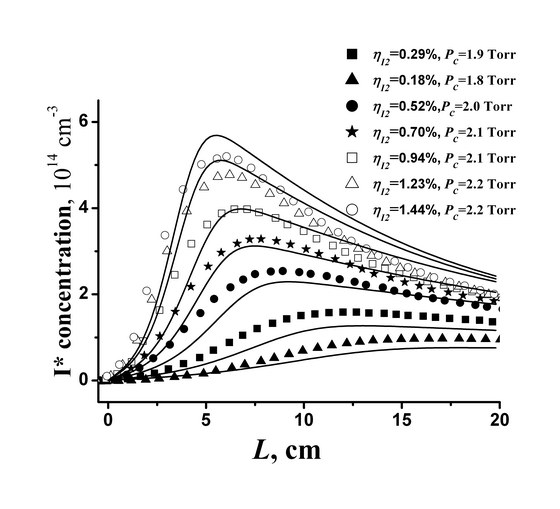
Рис. 5. Зависимость концентраций I* от координаты по потоку при доле воды 3 %, для состава смеси O2:N2=1:1. Гладкие кривые расчеты с использованием многоканальной модели диссоциации. Максимумы кривых смещаются в вверх и влево при увеличении относительного содержания паров йода.
Анализ полученных экспериментальных результатов позволил выявить промежуточные возбужденные состояния, играющих ключевую роль в диссоциации, и предложить механизмы их заселения в кислородно-йодной среде. Был предложен многоканальный механизм диссоциации молекулярного йода, который удовлетворительно объясняет наблюдаемые темпы диссоциации не только в наших экспериментах с проточной камерой, но и в действующей установке КИЛ в лаборатории профессора Розенвакса (Израиль, университет Бен-Гуриона). Необходимо отметить высокий вклад сотрудников его лаборатории в развитии теории диссоциации йода.
Кинетические исследования проведенные в университете Эмори (США, Атланта) в лаборатории Майкла Хэвена. Во-первых, мне хотелось бы выразить профессору Майклу Хэвену огромную благодарность за предоставленную возможность работать в его прекрасно оснащенной лаборатории. Мы выполнили целый ряд экспериментов по измерению кинетических констант химических и энергообменных процессов в смесях O2/O3/I2/CF3I/N2O/NO/NO2 используя ИЛФ, ЛИФ, время-разрешенную ЭС и т.д. Для выявления роли электронно-возбужденной молекулы I2(A') в диссоциации йода мы измерили константу скорости его тушения на CO2, I2 и Ar. Было найдено, что значение константы скорости тушения I2(A') на CO2 было относительно маленьким KCO2 = 8.5x10-13 cм3/с по сравнению с константой скорости его тушения на молекуле кислорода - KO2=6.3x10-12 cм3/с. Это подтвердило наше наблюдение в экспериментах с проточной камерой, что добавление CO2 в кислородно-йодную смесь в пропорциях до CO2:O2=3:1 не влияет существенно на скорость диссоциации (Azyazov V.N. and Heaven M.C., AIAA Journal, 2006, vol. 44, p. 1593-1600, doi: 10.2514/1.18230).
В последнее время совершен громадный скачок в развитии КИЛ в котором используется электрический разряд для наработки синглетного кислорода. В лаборатории Дэвида Кэррола мощность излучения электроразрядного КИЛ была доведена выше 500 Вт за короткий срок. Особенностью электроразрядного ГСК является присутствие в продуктах атомарного кислорода. В послеразрядной зоне в ходе рекомбинации атомов кислорода образуется озон. К тому же для эффективной работы ГСК требуется добавление некоторого количества окислов азота. Поэтому неизбежно появляются дополнительные каналы дезактивации I(2P1/2) и O2(a1Δ) в процессах с вовлечением O, NO, NO2, N2O2, N2O и O3. Мы измерили значения констант скоростей тушения I(2P1/2) на этих компонентах с использованием техники ИЛФ.
Одной из проблем в проведении экспериментов стало образование побочных продуктов в ходе приготовления смесей. Необходимо было смешать исходные компоненты за времена меньших 10 мс. Нами была сконструирована фотолизная ячейка, показанная на рис. 6, в которой смесь из I2 и O3 смешивалась и доставлялась в зону фотолиза за время меньше 10 мс. Центральной частью ячейки является цилиндрический канал диаметром 1 см с подвижным инжектором 1 вдоль центральной оси. Поток из O3 и N2 вводился в верхней части ячейки через порты 3. Поток I2/N2 вводился через боковые отверстия в подвижном инжекторе. Расстояние от конца инжектора до фотолизной зоны мог варьироваться от 1 до 6 см. Рукава-поглотители рассеянного света обдувались небольшим расходом буферного газа через порты 4. Кварцевые окна 5 для ввода/вывода фотолизного излучения и окно 6 для вывода регистрируемого излучения обеспечивали герметичность ячейки.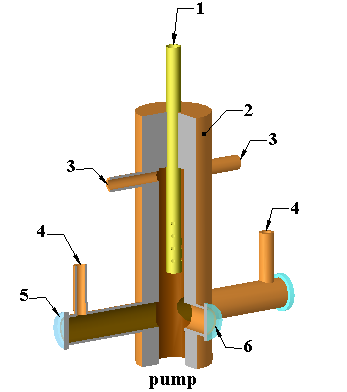
Рис. 6. Вид фотолизной ячейки в разрезе. 1- подвижный инжектор, 2- корпус, 3 – порт ввода газов, 4 – порт ввода обдувочного газа, 5 – окно для ввода/вывода фотолизного излучения, 6 – окно для вывода детектируемого излучения.
Скорость тушения электронно-возбужденных атомов I(2P1/2)
определялась из скорости затухания интенсивности излучения на 1315 нм. ИЛФ молекул йода на длине волны 485 нм
I2(X)
+ 485 нм -->I2(B)-->I(2P1/2) + I(2P3/2)
-->I2(1u)--> I(2P3/2) + I(2P3/2).
использовался для наработки I(2P1/2)
в экспериментах по измерению константы скорости тушения на озоне. Выход возбужденных атомов йода при фотолизе [I(2P1/2)]/( [I(2P1/2)]+
[I(2P3/2)])= 0.23-0.3 довольно высокий. С другой стороны фотодиссоциация молекул озона на этой длине волны незначительная.
Для изучения кинетики тушения I(2P1/2) на атомах кислорода O(3P) использовался ИЛФ смеси I2/O3/N2 на длине волны 248 или 266 нм. Продуктами фотолиза преимущественно являются O(1D) и O2(a1Δ)
O3 + 266 или 248 нм --> O(1D) + O2(a1Δ).
Атомы I(2P1/2) образовывались в ходе EE-обмена с молекулами O2(a1Δ). Фотодиссоциация йода на этих длинах волн незначительная.
Кинетика тушения I(2P1/2) на окислах азота
изучалась с использованием ИЛФ молекул CF3I на длине волны 245 нм.
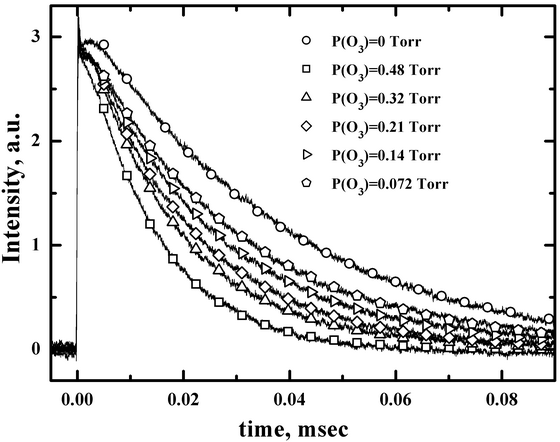
Рис. 7. Временные профили интенсивности излучения I(2P1/2) после ИЛФ смеси I2/O3/N2 на длине волны 485 нм для нескольких значений парциального давления озона при Ptot=17 Toрр и PI2=28 мToрр. Символами показаны аппроксимационные точки. (Azyazov V.N. et al. J. Phys. Chem. A., 2007, vol. 111, p. 3010-3015, doi: 10.1021/jp068546g).
Основные результаты:1. Внесен вклад в развитии модели диссоциации молекулярного йода Heidner- Lilenfeld-Azyazov-Pichugin-Heaven (Azyazov V.N. et al. J. Chem. Phys., vol. 130, 2009, p. 104306(9), doi: 10.1063/1.3081454).
2. Измерены населенности колебательно-возбужденных молекул кислорода на выходе химического ГСК и в активной среде химического КИЛ с использованием эмиссионной спектроскопии (Antonov I.O. et al. Chem. Phys. Lett., vol. 376, 2003, p. 168-173, doi: 10.1016/S0009-2614(03)00998-9).
3. Измерены значения констант скоростей жидкостной реакции молекулы хлора с ионами HO2- и
Cl2 + HO2-
→ k= (7.7±3)×10-13 cм3с-1
Cl2 + OH-
→ k= (6.8±2.7)×10-13 cм3с-1
4. Измерены значения констант скоростей химических и энергообменных процессов в смеси O2/O3/I2/CF3I/CO2/NO2/N2O с использованием ИЛФ, ЛИФ, ЭС в лаборатории Майкла Хэвена:
I2(A') + CO2 --> I2(X) + CO2 (8.5±0.9)x10-13
cм3/с
http://arc.aiaa.org/doi/abs/10.2514/1.18230
О2(b1Σ) + CO2 --> О2(a1Δ)
+ CO2 (6.1±0.5)x10-13
cм3/с
http://www.sciencedirect.com/science/article/pii/S0009261409012160
О2(b1Σ) + O3 --> продукты (1.9±0.2)x10-11
cм3/с
http://www.sciencedirect.com/science/article/pii/S0009261409012160
I(2P1/2) + O(3P)
--> I + O(3P) (1.2±0.1)x10-11
cм3/с
http://pubs.acs.org/doi/abs/10.1021/jp068546g
I(2P1/2)
+ O3 --> продукты (1.8±0.4)x10-12
cм3/с
http://pubs.acs.org/doi/abs/10.1021/jp068546g
I(2P1/2) + NO2 --> I + NO2 (2.9±0.3)x10-15
cм3/с
http://pubs.acs.org/doi/abs/10.1021/jp0741511
I(2P1/2) + N2O4
--> продукты (3.7±0.5)x10-13
cм3/с
http://pubs.acs.org/doi/abs/10.1021/jp0741511
I(2P1/2) + N2O --> I + N2O (1.3±0.1)x10-15
cм3/с

